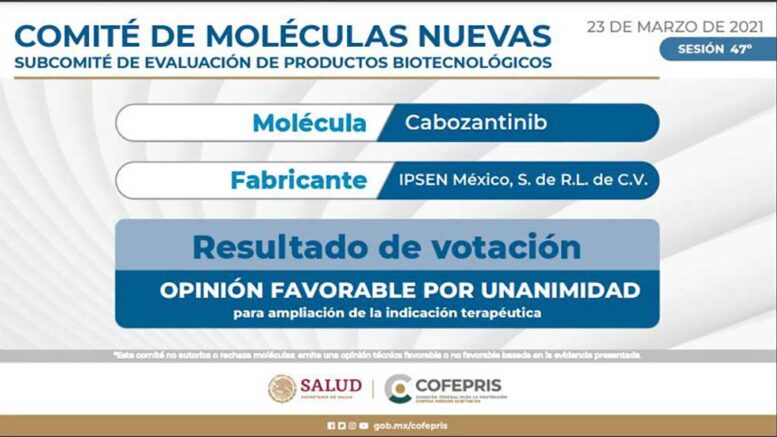
El Comité de Moléculas Nuevas (CMN), en conjunto con el Subcomité de Evaluación de Productos Biotecnológicos (SEPB), sesionó hoy, martes 23 de marzo de 2021, sobre los medicamentos oncológicos Cabozantinib, Goserelina y Nivolumab.
 El CMN es un órgano auxiliar de consulta y opinión a solicitudes relacionadas con medicamentos y demás insumos para la salud. El SEPB es parte del CMN y es un grupo multidisciplinario de especialistas, responsables de la evaluación previa de la información técnica y científica presentada de Medicamentos Biotecnológicos Innovadores y Biocomparables. Son parte de la Comisión de Autorización Sanitaria de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris).
El CMN es un órgano auxiliar de consulta y opinión a solicitudes relacionadas con medicamentos y demás insumos para la salud. El SEPB es parte del CMN y es un grupo multidisciplinario de especialistas, responsables de la evaluación previa de la información técnica y científica presentada de Medicamentos Biotecnológicos Innovadores y Biocomparables. Son parte de la Comisión de Autorización Sanitaria de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris).
Ambos están integrados por expertas y expertos en su campo y no autorizan o rechazan moléculas; emiten una opinión técnica favorable o no favorable basada en la evidencia presentada, misma que es integrada a su expediente para presentar ante la Comisión de Autorización Sanitaria.
47° Sesión Extraordinaria:
La primera molécula a consideración de opinión fue el medicamento oncológico Cabozantinib, presentado por IPSEN México, S. de R.L. de C.V.
Cofepris informa que el medicamento oncológico Cabozantinib recibió una opinión favorable unánime por parte de las y los expertos para la inclusión de una indicación terapéutica para el tratamiento del carcinoma de células renales (CCR) avanzado; en combinación con nivolumab para el tratamiento de primera línea del CCR avanzado en adultos, misma que deberá presentar ante la Comisión de Autorización Sanitaria.
 La segunda molécula a consideración de opinión fue el medicamento oncológico Goserelina, presentado por AstraZeneca, S.A. de C.V.
La segunda molécula a consideración de opinión fue el medicamento oncológico Goserelina, presentado por AstraZeneca, S.A. de C.V.
Cofepris informa que el medicamento oncológico Goserelina recibió una opinión favorable unánime por parte de las y los expertos para la ampliación de indicación terapéutica para el tratamiento de cáncer de mama con receptores de estrógenos positivos en mujeres premenopáusicas, misma que deberá presentar ante la Comisión de Autorización Sanitaria.
La tercera molécula a consideración de opinión fue el medicamento oncológico Nivolumab, presentado por Bristol-Myers Squibb de México, S. de R.L. de C.V.
Cofepris informa que el medicamento oncológico Nivolumab recibió una opinión favorable por parte de la mayoría de las y los expertos para la adición de indicación terapéutica para el tratamiento como monoterapia o en combinación con ipilimumab para el tratamiento de pacientes con carcinoma hepatocelular (HCC) que han sido previamente tratados con sorafenib, misma que deberá presentar ante la Comisión de Autorización Sanitaria.
 Estas decisiones son parte del proceso de aprobación requerido por la Cofepris para el cumplimiento de los requisitos de calidad, seguridad y eficacia necesarios al considerar un producto.
Estas decisiones son parte del proceso de aprobación requerido por la Cofepris para el cumplimiento de los requisitos de calidad, seguridad y eficacia necesarios al considerar un producto.
La Cofepris, como parte de su proceso de optimización de los procedimientos del Comité de Moléculas Nuevas anunciado a principios de mes, seguirá informando sobre las opiniones y sesiones del CMN, manteniendo su compromiso de ser una institución transparente, eficiente, innovadora y de referencia, con la salud de las personas en el centro de su misión.